肿瘤精准活检的晶准突破
肿瘤的早筛早诊,精准诊疗和动态监测是提高肿瘤患者生存率和降低死亡率的关键。
目前,传统的肿瘤检测方法,包括组织活检,影像学等,存在诸多不足,如:成本高、取样难、创伤大、滞后性等,难以做到早筛查、早治疗以及治疗后的随访与实时指导治疗。
作为体外诊断的一个分支,肿瘤液体活检发展迅速,通过检测外周血液中存在的循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTC)以及携带有细胞来源相关的多种蛋白质、RNA、DNA、脂质等的外泌体(exosome)等生物标记物,以相对非侵入的方式对血液及体液中的肿瘤细胞和肿瘤相关分子标志物进行精准检测,具有副作用小、操作简单、能重复取样等优点。
首先,作为肿瘤液体活检最重要的标记物CTC,由于其蕴含的临床信息丰富,一直是临床和学术研究的热点。目前全球范围内注册在内的CTC的临床研究共计962例,其主要临床应用包括肿瘤早期辅助诊断、用药指导、治疗监测、复发监测等方面。在早期辅助诊断方面,有研究证明对慢性阻塞性肺疾病患者进行CTC检测并随访,能早于影像学发现肿瘤,真正做到了肿瘤的早发现、早诊断[1]。
在AJCC第8版指南当中,针对在乳腺癌患者的CTC检测技术能够为临床提供预后及复发预警的信息[2]。疗效动态监测是CTC目前临床应用的发展方向,通过治疗过程中不同时间点的CTC数目的变化趋势用于监测肿瘤对治疗的反应并指导下一步的治疗[3]。
目前由于CTC检测技术没有统一标准,技术门槛较高,各种检测技术参差不齐,分离鉴定方法的局限性等原因易造成CTC检测结果的偏差。
如何突破其检测灵敏度和特异性偏低是行业十多年来一直面临的一大难题,也是导致CTC检测项目还得不到临床广泛认可的关键因素。
基于EpCAM等CTC标记物的Cell Search方法虽然是目前唯一被FDA批准的CTC检测技术,但是临床灵敏度只有40-60%,显然无法满足临床需求[4]。CTC检测技术的精进与优化是其能应用于临床的重要前提。目前,不少研究团队和企业推出了新的CTC检测技术,其中晶准医学(CellomicsTM)开发的CTC100技术平台将先进的微流控芯片分选技术和肿瘤多重标记物鉴定技术相结合,CTC检测的灵敏度和特异性同时提高到90%以上。
随着CTC研究的深入,除了临床的应用,在CTC细胞上的研究也逐渐向单细胞方向发展,以获取肿瘤异质性的信息。在单细胞水平上对CTC进行基因组、转录组、蛋白质组分析,以及CTC体外模型的不断完善[5],可促进肿瘤研究的不断深入,为肿瘤诊断、预后、治疗、病因机制和药物开发等领域开拓新的视野。

晶准医学自主研发的CELLOMICSTMCTC100循环肿瘤细胞分选仪,利用自主研发惯性聚焦微流控芯片技术,搭载多种肿瘤标记物的专用细胞鉴定试剂盒,检测灵敏度和特异性均达90%以上,不仅检测精准,而且具有CTC的可获取性及完整性,目前已经在富集浓度上突破3%的瓶颈,全面打破CTC富集鉴定到下游分析的应用屏障,已为临床提供CTC计数与分型信息,免疫治疗靶向蛋白检测以及用药靶点基因检测等信息,可拓展应用于全基因组测序、体外培养及药敏评估等,为肿瘤早期筛查、预后判断、伴随诊断、复发预警、疗效监测等提供精准信息。
高通量测序技术NGS是肿瘤精准检测的主流,备受临床医生青睐。但目前临床检测结果显示基于DNA-NGS为技术的测序技术在肿瘤基因检测方面存在着15%左右的[6]融合基因漏检现象。其原因是因为大多数NGS平台均采用Ampliseq(双端锚定PCR)的建库、扩增方法,无法利用短片段核酸、无法检测未知断点融合、无法检测未知融合伙伴融合、且只适用于组织样本。
目前国内外多个研究已表明以RNA为模板的NGS(RNA-NGS)方法进行融合/重排、易位等基因突变的检测,要显著优于以DNA为模板的NGS(DNA-NGS)检测[6,7]。在DNA-NGS检测为阴性的NSCLC患者中,通过RNA-NGS方法检测发现仍有5%-15%的患者携带可进行靶向治疗的融合/重排基因突变,而且DNA-NGS检测时Panel越大,检测结果中融合基因的漏检率就相对越高。在纽约纪念斯隆凯特琳癌症研究中心(MSKCC)的一项研究中[6],经DNA-NGS检测为阴性的232例患者,经RNA-NGS检测又发现36例常见的可治疗的融合/重排变异,且经过靶向治疗后,临床获益率达80%。这表明部分泛阴性的患者中基于DNA的NGS检测的漏检率高达14.2%。
NCCN指南中关于非小细胞肺癌正式推荐的8个治疗靶点中,有5个基因突变(63%)为融合/重排和跳读变异。NCCN指南[8]也着重指出经过广泛基因检测未发现有肿瘤驱动基因的患者,特别是那些无吸烟病史的非小细胞肺癌患者,应使用基于RNA为模板的NGS进行检测,从而更大程度检出融合基因突变,避免假阴性结果;目前研究数据表明,DNA-NGS检测可能会漏检ROS1融合,NTRK1和NTRK3融合等。而2021第一版的NCCN指南指出[8]:NGS检测是目前METExon 14跳读的最主要检测方法,相比于DNA-NGS检测,RNA-NGS检测方法在METExon 14跳读、RET融合/重排的检测上也表现出更多优势。
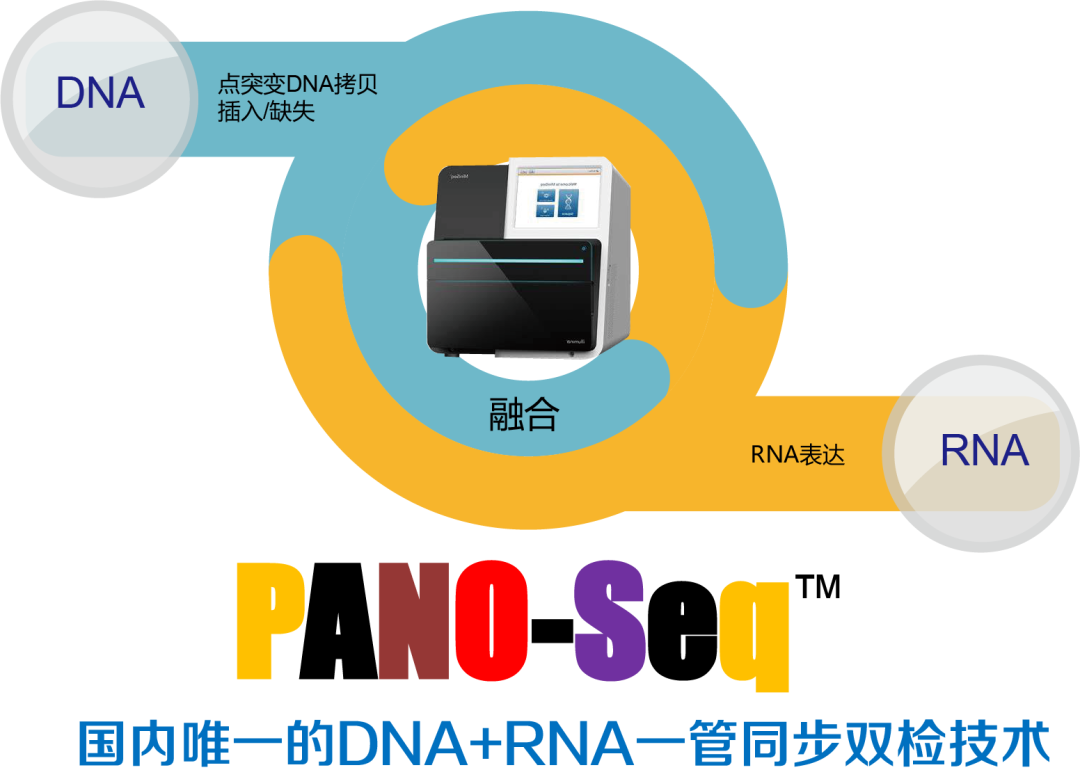
PANO-Seq®技术是唯一可以实现肿瘤一管标本DNA+RNA同步基因测序的NGS专利技术。PANO-Seq®采用单端锚定PCR法进行同步建库和基因扩增,大大提高了短片段核酸利用率,全面覆盖已知和未知融合基因靶点,该技术方案已被CSCO写进了中国临床肿瘤学进展2020红宝书之中。与大多数只检测ctDNA的技术平台相比,PANO-Seq®平台可以多检出12%-16%的基因融合事件,为患者提供了更多的精准用药靶点!与少数平台采用AMP(双端锚定PCR)法对DNA+RNA分步测序相比,只有PANO-Seq®(单端锚定PCR)可以检测出未知的基因融合事件,为临床医生提供更多的精准诊疗依据!是目前肿瘤基因测序最受精准医学实验室欢迎的技术方案之一。
而作为目前检测灵敏度可以媲美一代测序技术(Sanger)、具有绝对定量功能的数字PCR的产业化及临床应用发展相当迅速。迄今为止,已有包括Fluidigm和Bio-Rad等几家公司相继推出了数字PCR产品,并已经应用于单细胞分析、癌症早期诊断和产前诊断等研究领域。
同时,数字PCR技术也同样是是肿瘤精准检测技术的重要发展方向,该技术可以更精准检测肿瘤已知基因靶点突变,包括用药靶点及耐药突变,更精准指导用药,适用于液体活检以及肿瘤早期血液检测。但由于目前数字PCR平台普遍存在的通量低和检测成本高等因素,制约了其临床推广使用,主要还是在科研方向的应用较多。

晶准医学最新推出的晶点TM数字PCR平台,在国际上首创不需要芯片的微滴阵列打印技术,在液滴生成有效率、检测精确度和检测时间等关键技术指标上均超越了大多数进口品牌,尤其适用于与CTC单细胞相结合进行基因检测,以及ctDNA丰度较低的早期肿瘤用药靶点的绝对定量检测。晶点数字PCR平台在保证检测精度和灵敏度的同时,由于无需昂贵的芯片耗材,大幅降低了检测的成本,更加适合应用于检测收费较低的病原微生物检测、生殖健康遗传病检测等等。

晶准医学(Cellomics)是一家集精准医疗液体活检技术研发、产品转化、生产、销售以及检测服务为一体的高新技术企业,依托香港城市大学在生物芯片和基因检测领域的专利和创始团队多年科研积累,拥有国际先进的、自主知识产权的微流控技术与核酸检测技术,为肿瘤液体活检提供全方位的精准诊断产品、方案以及服务,并率先推出CTC+数字PCR+NGS的“肿瘤液体活检整体解决方案”。
晶准医学将于2021年3月28日至30日在重庆国际博览中心召开的第十八届国际检验医学既输血仪器试剂博览会(CACLP)会上,隆重推出全球首创的无芯片式“晶点数字PCR”平台,在液滴生成有效率、检测精确度和检测时间等关键技术指标上处于国际领先水平,该平台利用微滴液面震动原理,大幅降低检测耗材的成本,尤其适用于与CTC单细胞相结合以及早期肿瘤血液中ctDNA的肿瘤已知用药靶点突变绝对定量检测的科学研究,还可以广泛应用于病原微生物检测、生殖健康遗传病检测等等。
作为国内目前唯一自主研发CTC、NGS和数字PCR三大平台的企业,晶准医学正积极顺应政策变化,致力于为医院自建或共建精准医学实验室提供“全方位肿瘤活检整体解决方案”,加速在肿瘤活检赛道上实现弯道超车。
2021年3月28日至30日在重庆国际博览中心召开的第十八届国际检验医学既输血仪器试剂博览会(CACLP),晶准医学将展示CTC、NGS和数字PCR三大平台,欢迎广大客户莅临指导!
展位号:N3-T021
参考文献
[1]Ilie M,et al. "Sentinel" circulating tumor cells allowearly diagnosis of lung cancer in patients with chronic obstructivepulmonary disease .PLoS One 2014 ; 9 : e111597
[2]American Joint Committee on Cancer: breast cancer. version 8. 2020.
[3]Shishido SN, et al.Circulating tumor cells as a response monitor instage IV non-small cell lung cancer. J Transl Med. 2019;17:294
[4]Wallwiener M, et al Serial enumeration of circulating tumor cellspredicts treatment response and prognosis in metastatic breastcancer: a prospective study in 393 patients. BMC Cancer. 2014 Jul11;14:512.
[5]Song Y, et al. Enrichment and single-cell analysis of circulatingtumor cells. Chem Sci. 2017 Mar 1;8(3):1736-1751.
[6]Benayed R, et al. High Yield of RNA Sequencing for Targetable KinaseFusions in Lung Adenocarcinomas with No Mitogenic Driver AlterationDetected by DNA Sequencing and Low Tumor Mutation Burden. Clin CancerRes. 2019 Aug 1;25(15):4712-4722.
[7]Detection of novel NRG1, EGFR and MET fusions in lung adenocarcinomasin the Chinese population. Journal of Thoracic Oncology. 2019;14(11):2003-2008.
[8]NCCN clinical practice guidelines in Oncology: Non-Small Cell LungCancer. Version 1.2021.
(检验医学官方号)
